今回はボーアの原子モデルをベースに,電子のもつエネルギーや原子に出入りする光について考察していきます。
エネルギー準位の計算
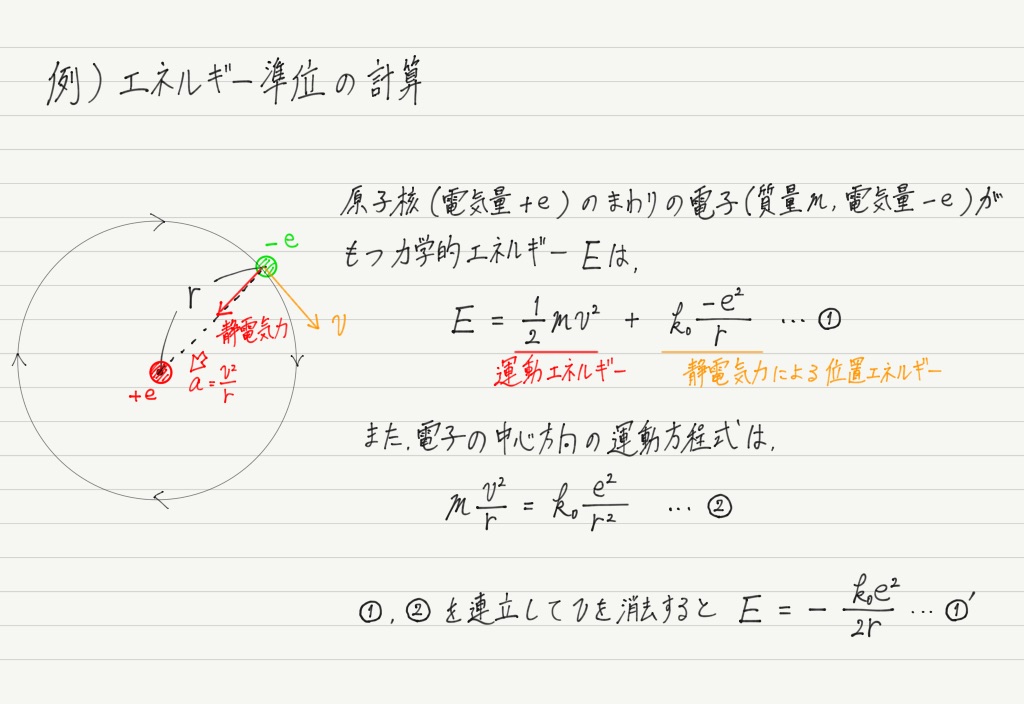
定常状態にある電子がもつ力学的エネルギーのことをエネルギー準位といいます。
ボーアの原子モデルを用いて,水素原子がもつ電子のエネルギー準位を具体的に計算してみましょう!
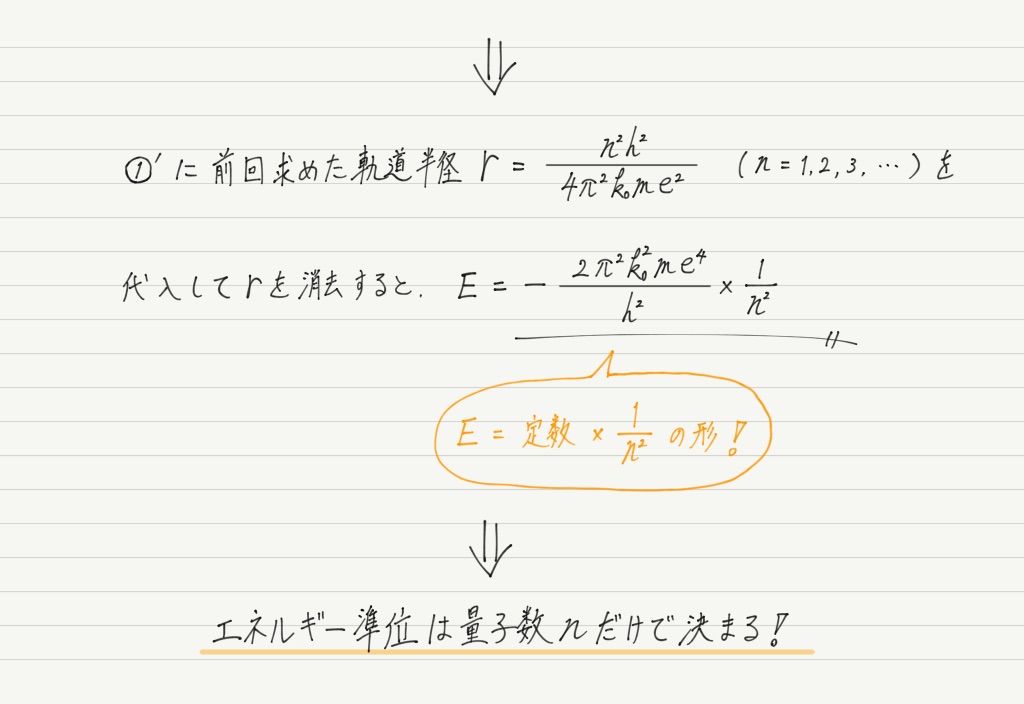
これまた興味深い結果!!
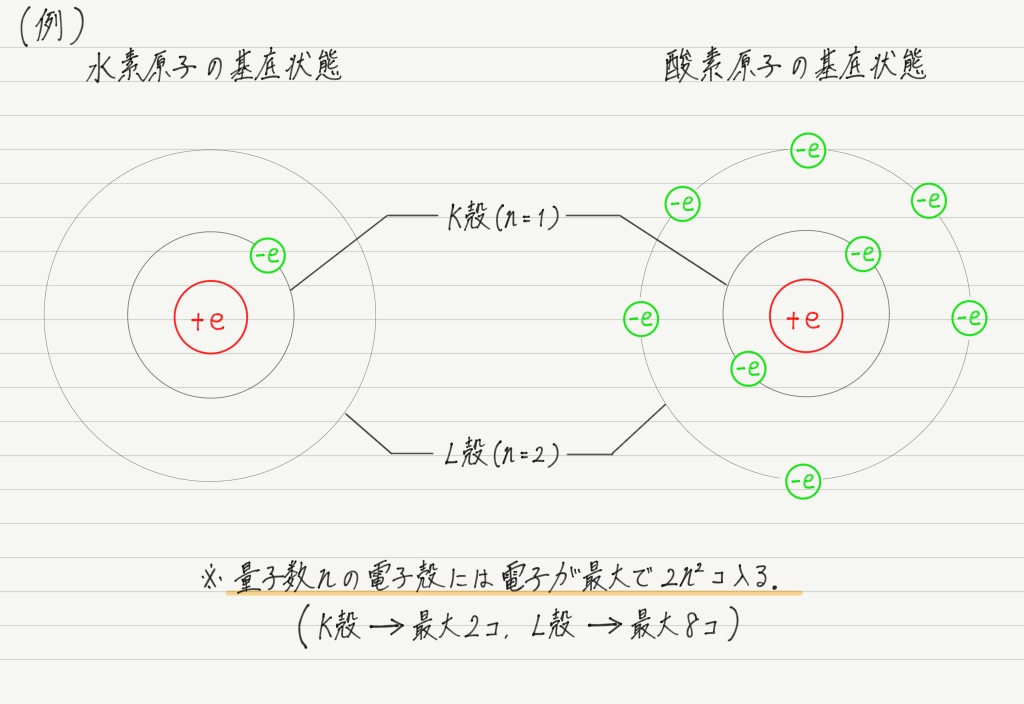
エネルギー準位が量子数 n だけで決まということは,言い換えると電子のエネルギー準位は,“電子がどの電子殻に入っているか” で完全に決まってしまうということ。
ちなみに原子は普段はなるべくエネルギーが小さい状態(基底状態)を保とうとします。
上の式を見ると,n= 1のときが最もエネルギーが小さくなるので,水素原子の電子は普段はK殻にいることがわかります。
電子を2個以上もつ原子の場合,基本的には電子が内側から埋まっている状態が,その原子の基底状態になります。
原子が発する光
化学の授業で「電子は内側から埋めていく」と習ったのは原子の基底状態の話だったわけですね。
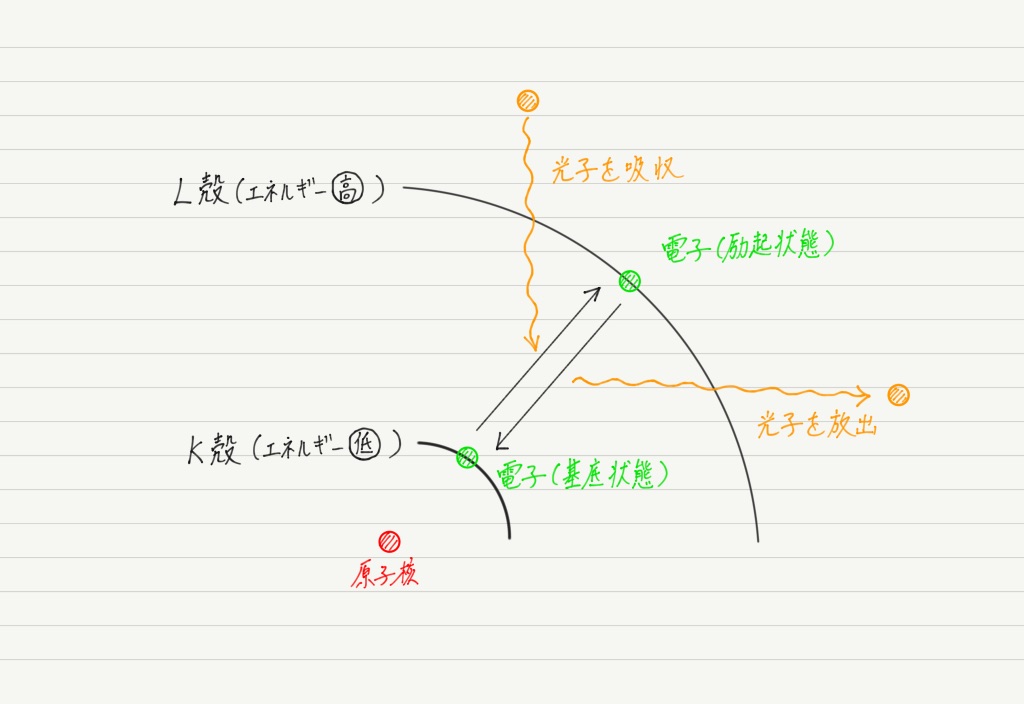
じゃあ例えば水素原子の中の電子は常にK殻にいるのかというと,実はそうでもありません。
K殻を空いたままにして,外側に電子がいる状態(エネルギーが高い状態)を励起(れいき)状態といいます。
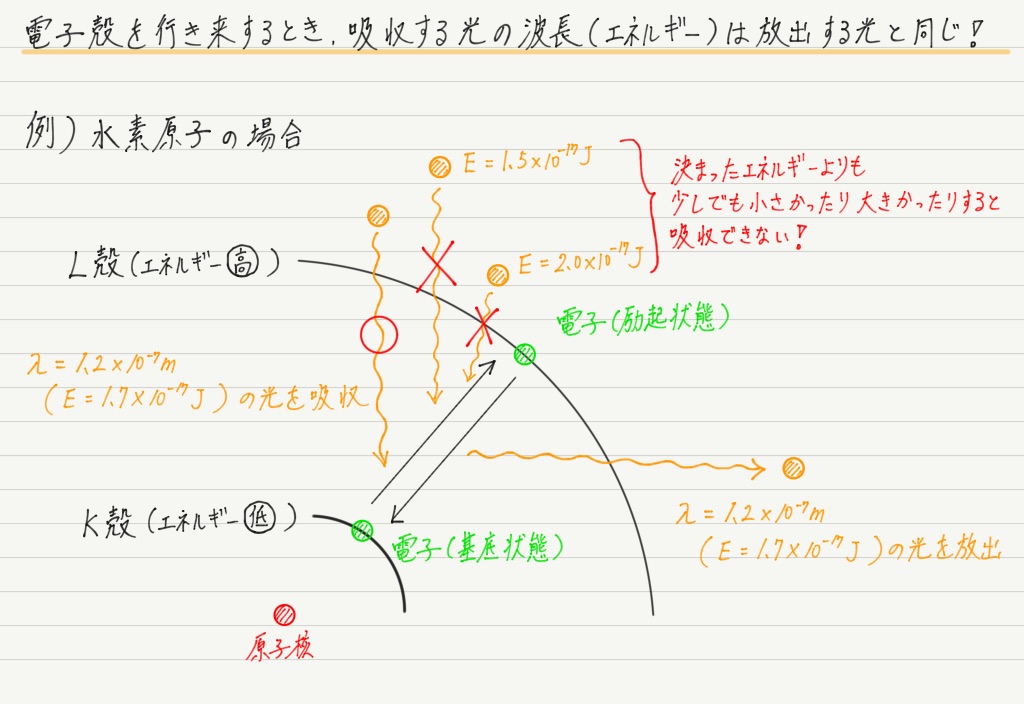
原子がいつ励起状態になるのかというと,電子が光子からエネルギーを受け取ったときです。
逆に励起状態から基底状態に戻るときは,余分なエネルギーを光子として放出します。
ここでさっきの話を思い出してください。
エネルギー準位は電子がどの電子殻にいるのかによって完全に決まっているので,K殻とL殻の間のエネルギー差や,L殻とM殻の間のエネルギーの差も決まっていることになります。
エネルギー幅が決まっているということは,電子が外側の電子殻から内側の電子殻に戻るときに放出する光の波長も決まります。
つまり,水素原子は決まった波長の光しか出せないのです!
ここでは水素原子に限定して計算をしましたが,それ以外の原子でも原子の種類ごとにエネルギー幅が決まっていて,原子ごとに決まった波長の光しか出せない(線スペクトル)ことが示されます。
波長がX線領域ならば,それがその原子の固有X線となります。
(計算こそしていませんが,X線の記事でも同じ話をしています。)
ところで,原子ごとに決まった波長の光が放出されるということを逆手にとって,出てきた光の波長を調べることで原子の種類を特定することもできます。
もしも出てくる光が可視光線ならば,色を見て特定することだって可能。
例えば黄色い光が見えればNa原子,青緑色の光が見えればCu原子。
…これって炎色反応じゃん!
前回の電子殻の話といい,化学で習った現象の理由が,次から次へと物理で解明されていきます。快感。
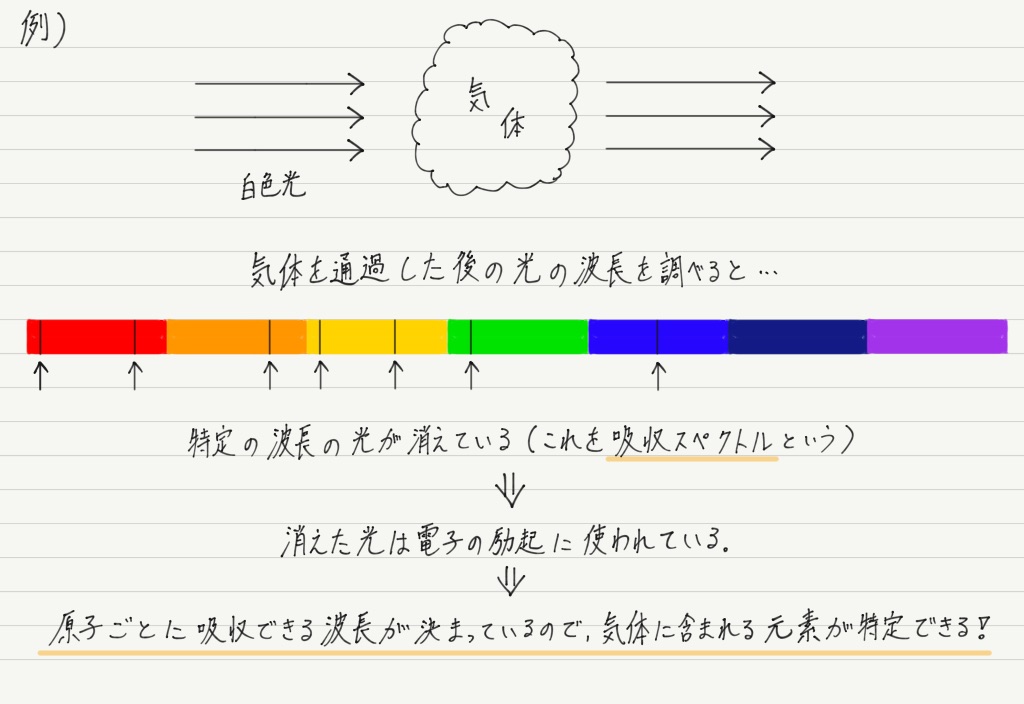
吸収スペクトル
“決まった波長の光” は出すときだけの話ではありません!
電子が励起状態へ移るときも,決まった波長の光(=決まったエネルギーの光)しか受け取れないのです。
放出するときはまだしも,受け取る分には余計に受け取ってもいいじゃないか,と我々は思ってしまいがちですが,そうではないんですね〜
さて,炎色反応は出ていく光を観察して元素を特定するわけですが,吸収する光でも同じように元素の特定が可能です。
このような吸収スペクトルは太陽など,恒星から届く光にも確認されます。
消えている波長が何の元素に対応しているのかを調べることで,遠く離れた恒星の大気の組成や状態を把握することができます。 すごい!
今回のまとめノート
時間に余裕がある人は,ぜひ問題演習にもチャレンジしてみてください! より一層理解が深まります。
電子殻の存在やエネルギー準位などいろいろな結果を与えてくれるボーアの原子モデルですが,やはりこれも完璧な原子モデルではありません。
大きな欠点として,水素原子以外のエネルギー準位をうまく説明できない(計算結果と実験結果が合わない)という点が挙げられます。
残念ながらこの先は大学レベルの話になってしまうので,原子がどういう構造をしているのかという追求はいったんここで休止しましょう。
次回予告
次回は原子よりもさらに小さい領域,原子核の話へと進んでいきます。