比熱や熱容量を学んで,物質に熱を加えたときの温度変化を計算できるようになりました。 しかし思い起こしてみてください。
「水は100℃で沸騰し,加熱し続けても温度は100℃のまま」
これは小学校の理科の時間に習う事実ですが,熱を加えているのに温度が変化しないってどういうこと? 今回は熱と温度上昇の関係について学習していきましょう!
【復習】物質の状態変化
まず物質は基本的に固体,液体,気体の3つの状態があり,圧力・温度でそのうちのどの状態になるかが決まります(今回は圧力は1気圧に固定して考えましょう)。
通常の物質は熱を加えると固体→液体→気体へと変化します。
分子どうしがガッチリ結びついているのが固体,結びつきがゆるんだものが液体,結びつきが切り離されたものが気体でした。
固体から液体への変化を融解,液体から気体への変化を蒸発,液体から固体への変化を凝固,気体から液体への変化を凝縮といいます。
また,一部の物質(ドライアイス,ヨウ素,ナフタレンなど)は液体を経ずに,固体と気体を直接行き来します。
固体から液体を経ずに気体になることを昇華,気体から液体を経ずに固体になることを凝華といいます。
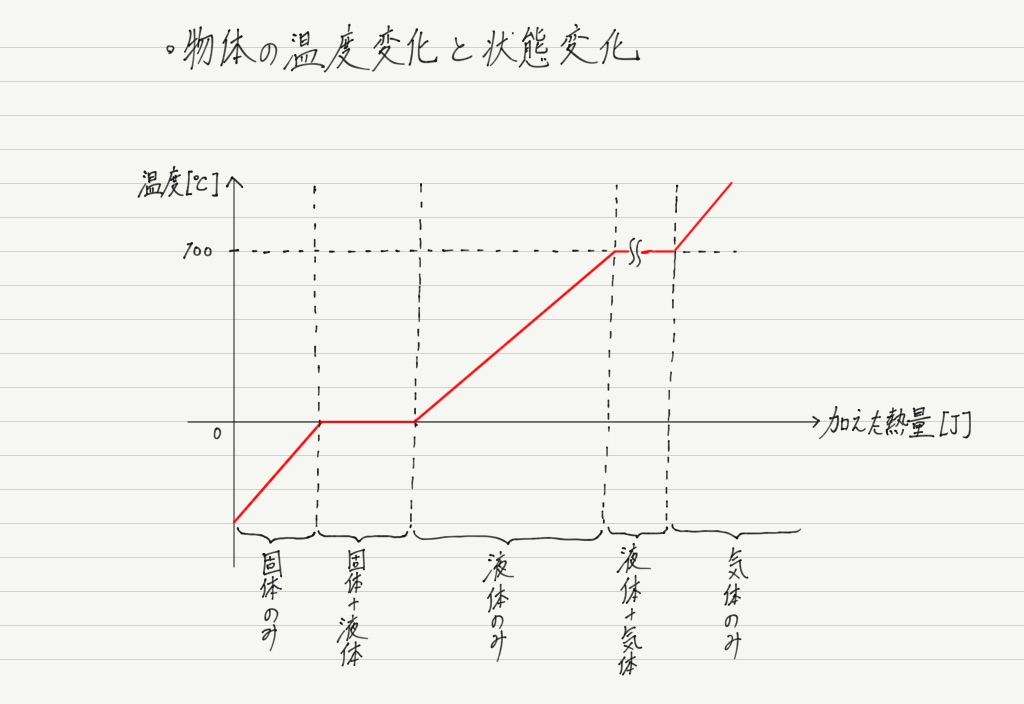
温度変化のグラフ
いちばん身近な物質である水を例に,温度変化の様子を見てみましょう。
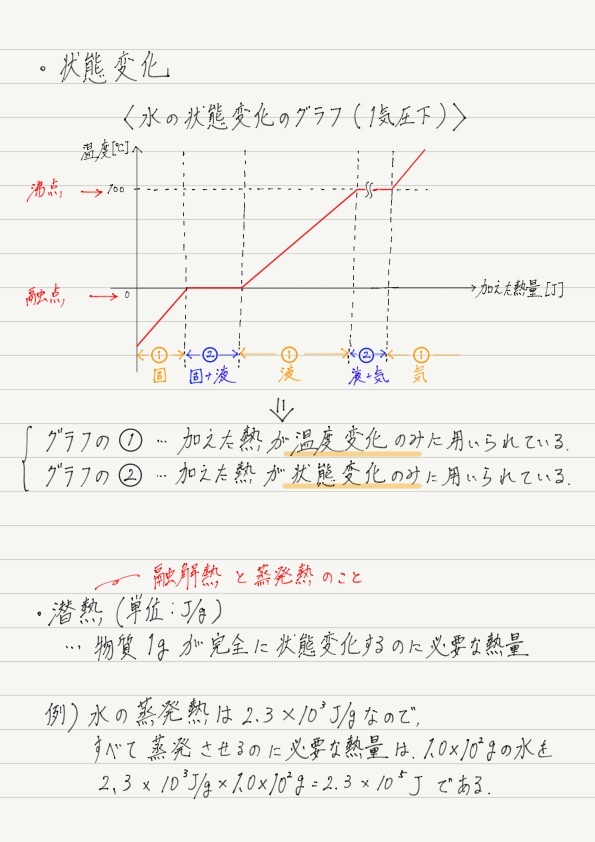
このグラフを見る上でのポイントは「加えた熱の使われ方」です。 実は熱には2通りの使われ方があります。
① 分子の熱運動を激しくするのに使われる熱と,② 分子間の結びつきを切り離すのに使われる熱です。
①の用途では温度が上昇し,②の用途では状態変化が起こります。
物質内での熱の使われ方
ここで先ほどのグラフをもう一度見てみましょう。
氷に熱を加えても,0℃になるまでは溶け出しません(固体だけの状態)。 しかし,0℃に達すると今度は一転し,全部溶けるまで温度は上がりません。
同様に,液体の水も100℃になるまでは沸騰しません(液体だけの状態)。 しかし,100℃に達すると,全部蒸発するまで温度は上がりません。
このことから,温度上昇と状態変化は同時に起こらない,ということがわかります。
これはつまり,加えた熱は①か②の用途で使われるが,熱の一部を①で,残りを②で〜といった使われ方はせず,どちらか一方に全振りされるということ!
潜熱
最後に用語を紹介します。 上記の②の用途(状態変化)に使われる熱は潜熱と呼ばれており,物質1gが完全に状態変化するのに必要な熱量として定義されています。
主な潜熱として融解熱と蒸発熱があります。定義と照らし合わせると,融解熱は1gの固体が完全に液体になるのに必要な熱量,蒸発熱は1gの液体が完全に気体になるのに必要な熱量ということになります。
今回のまとめノート
時間に余裕がある人は,ぜひ問題演習にもチャレンジしてみてください! より一層理解が深まります。
次回予告
次回は熱の分野における重要な法則になります!